ENZIMI NEL CORPO UMANO
fosfatasi acida (acp)
Le fosfatasi sono enzimi i
cui substrati sono costituiti da molecole contenenti un gruppo fosfato: l’enzima
catalizza la liberazione del fosfato dal resto della molecola. Le singole specie
enzimatiche hanno substrati preferenziali differenti. La fosfatasi acida ha
attività enzimatica ottimale a pH 5. Essa è presente in molti tessuti, anche se
la prostata rappresenta l’organo in cui questa attività enzimatica raggiunge
livelli più alti. Attività minori si trovano in: eritrociti, piastrine, fegato,
milza ed anche nel latte umano e a livelli molto elevati nel liquido seminale.
In clinica si determina solo
la forma prostatica di ACP, ed è di grande utilità per la diagnosi del carcinoma
prostatico. Un altro impiego frequente è nella diagnosi medico-legale di
stupro.
Il sangue dovrebbe essere
prelevato evitando emolisi ed il siero dovrebbe essere separato rapidamente dal
coagulo. La ACP ha un’attività estremamente labile: di conseguenza l’esame
dovrebbe essere effettuato entro poche ore o il siero dovrebbe essere congelato.
L’acidiificazione del campione con acido citrico stabilizza l’attività di ACP.
fosfatasi alcalina (alp)
Ha attività enzimatica
ottimale a pH 9. E’ praticamente ubiquitaria, a dimostrazione dell’importanza
essenziale del suo ruolo metabolico. I tessuti o le celule che ne presentano i
livelli più elevati sono: ossa, fegato, intestino, rene, leucociti, placenta. Le
attività ALP nei diversi tipi cellulari sono il prodotto di diversi geni ed è
quindi possibile distinguere isoenzimi ALP organo-specifici. I correnti metodi
per separare gli isoenzimi della ALP permettono una risoluzione modesta e sono
molto sensibili alle condizioni del campione (in particolrae alla sua
freschezza).
Si può avere un aumento del
livello sierico di fosfatasi alcalina in varie situazioni (in ordine
decrescente): ostruzione delle vie biliari, cirrosi biliare, epatopatie,
mononucleosi infettiva, metastasi ossee, osteopatie metaboliche (rachitismo),
epatiti virali, cirrosi, malattie infiammatorie dell’intestino, quali la colite
ulcerosa, fratture in via di guarigione, gravidanza (l’aumneto è dovuto
all’isoenzima di origine placentare, ed è privo di significato patologico),
bambini (le cui ossa sono in crescita).
La determinazione dei livelli
di ALP dovrebbe essere effettuauta su siero ottenuto da sangue raccolto a
digiuno e posto a sierare in provetta. Campioni di siero conservati per periodi
compresi da 1 a 4 giorni a temperatura ambiente possono presentare limitati
aumenti di ALP, contenuti se il campione è conservato in frigorifero.
transaminasi (aminotransferasi)
Sono gli enzimi che
catalizzano il trasferimento reversibile di un gruppo aminico tra un aminoacido
ed un α-chetoacido:
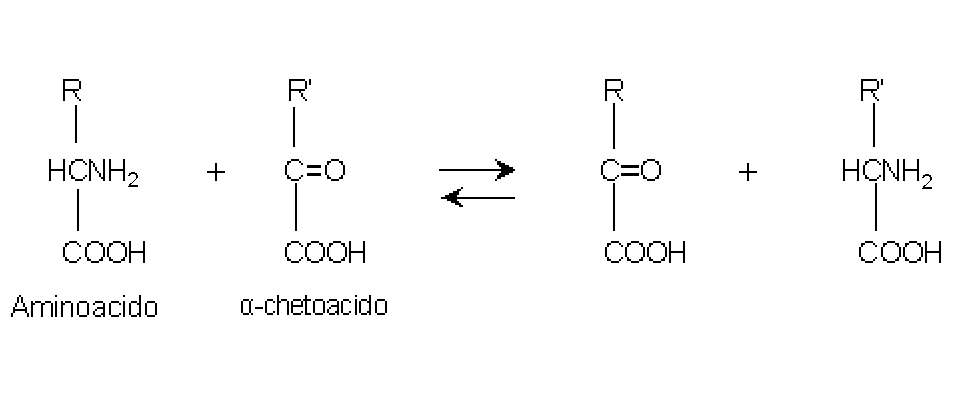
Le due transaminasi misurate
più frequentemente sono: alanina aminotransferasi (ALT), aspartato
aminotransferasi (AST). Entrambe richiedono la presenza di vitamina B6
come coenzima, la quale viene spesso aggiunta alla miscela di reazione per
consentire una ottimale determinazione dell’attività enzimatica anche in caso di
deficienza di B6.
Tali enzimi sono presenti in
molti tessuti dell’organismo; i livelli più alti di attività enzimatica sono
presenti nel fegato. Gli epatociti sono le uniche cellule con alti livelli di
ALT; reni, cuore e muscoli scheletrici contengono quantità minori dell’enzima, e
livelli ancora più bassi sono misurabili in pancreas, milza, polmoni ed
eritrociti. Quindi un aumento dei livelli sierici di ALT è indice relativamente
specifico di danno epatico. AST è presente in quantità notevoli nel fegato, ma
anche nel miocardio e nel muscolo scheletrico. Negli epatociti l’AST ha
un’attività circa 3-4 volte più elevata di quella di ALT.
Elevati livelli di AST e ALT
sono un indice significativo di danno epatico.
Come altri enzimi di origine
muscolare, anche AST può essere rilasciata da tessuto muscolare danneggiato da
infezioni, processi infiammatori, convulsioni.
ace (enzima di conversione dell’angiotensina)
Provvede alla conversione del
decapeptide angiotensina 1 nell’octapeptide ad azione vasocostrittoria
angiotensina 2. Questa conversione avviene principalmente a livello polmonare.
E’ prodotta dai macrofagi e dalle cellule epitelioidi.
Il più importante impiego
diagnostico rigurada la sarcoidosi in fase attiva, nella quale i livelli di ACE
sono elevati. Altre condizioni associate ad alti livelli di ACE sono il morbo di
Gaucher e la lebbra. I livelli possono essere elevati in molti soggetti sani di
eta inferire ai 20 anni e in circa il 5 % dei soggetti adulti.
colinesterasi:
pChE, AChE
L’attività colinesterasica
sierica è spesso detta ‘pseudocolinesterasi’ (o pChE), per distinguerla dalla
‘vera’ acetilcolinesterasi (o AChE), presente negli eritrociti e nelle
terminazioni nervose. L’acetilcolina è il neurotrasmettitore rilasciato a
livello della sinapsi della placca neuromuscolare allorchè l’impulso nervoso
raggiunge il muscolo. Essa diffonde nello spazio sinaptico e provoca la
depolarizzazione della fibra muscolare e la conseguente contrazione. La
trasmissione dello stimolo è interrotta dalla rapida scissione dell’acetilcolina
in acetato e colina, catalizzata dalla AChE. L’incapacità di inattivare l’acetilcolina
causa paralisi. La pChE presente nel siero origina dagli epatociti. L’AChE e la
pChE sono enzimi differenti identificabili in laboratorio grazie alle loro
diverse capacità catalitiche.
AchE: alta specificità,
quindi pochi substrati sono attaccabili dall’enzima; esplica attività
ottimale a basse concentrazioni di acetilcolina (substrato).
PChE: opera su un ampio
gruppo di esteri della colina; è attivo sia a basse che ad alte concentrazioni
di substrato.
Entrambe sonoinibite dagli
enzimi organofosforici.
E’ fondamentale nella
valutazione della funzionalità epatica e nella trasmissione nervosa.
γ
glutamiltranspeptidasi (γGT)
Catalizza il trasferimento di
residui di acido glutamico tra peptidi o singoli aminoacidi; il legame tra i
diversi composti e l’acido glutamico avviene tramite il carbossile in posizione
γ. E’
possibile che questa funzione enzimatica giochi un certo ruolo nel trasferimneto
degli aminoacidi attraverso le membrane cellulari. E’ presente in grandi
quantità nell’epitelio tubulare renale e nel fegato, e a livelli meno elevati
nel tessuto osseo. Rappresenta un indicatore molto utile in diverse epatopatie.
Un danno agli epatociti o agenti chimici epatotossici possono causare rilascio
di γGT,
così come anche alcol e barbiturici: la fuoriuscita dell’enzima nel siero sembra
dipendere da un aumento della sua concentrazione intracellulare. Essendo la
γGT molto
sensibile all’ingestione di alcol, è di grande utilità per seguire l’andamento
ed i risultati di terapie di disintossicazione. Sebbene la
γGT di
origine renale non sia mai presente nel siero, sue determinazioni nell’urina
possono essere impiegate per valutare danni ai tubuli renali dovuti a sostanze
nefrotossiche.
LATTICO DEIDROGENASI (LDH)
Catalizza
la conversione reversibile del lattato in piruvato ed utilizza il NAD+
come cofattore.
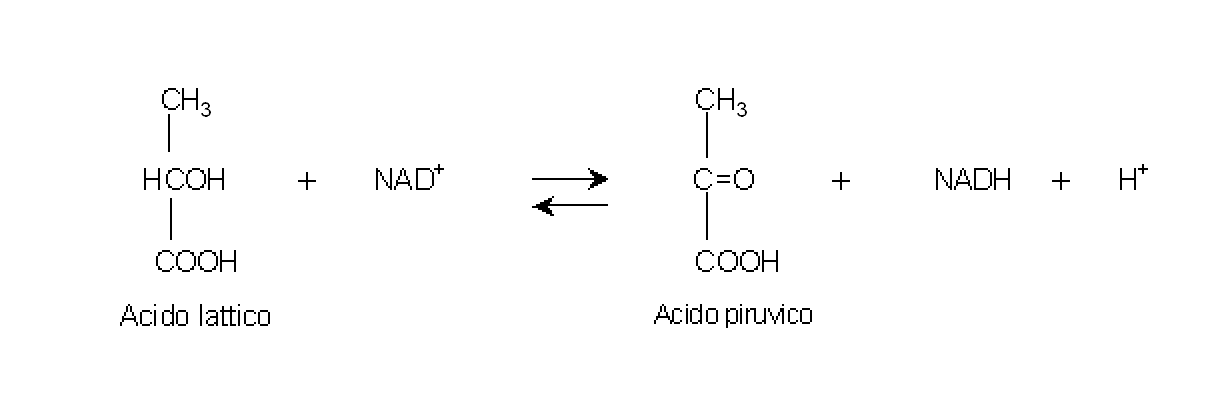
La lattico deidrogenasi è
virtualmente ubiquataria. E’ un tetramero che contiene 4 subunità di due
possibili tipi molecolari diversi, H ed M. Il risultato è che ci sono cinque
possibili isoenzimi di LDH presenti in:
LD1 (H4) e LD2 (H3M):
cervello, cuore, eritrociti
LD3 (H2M2):
cervello e reni
LD4 (HM3):
fegato, muscolo scheletrico, reni
LD5 (M4): fegato,
muscolo scheletrico, ileo
Essi hanno origini tissutali
diverse, che permettono di individuare per ogni forma un organo d’origine. Si
utilizzano varie tecniche per distinguere gli isoenzimi LDH, che sfruttano la
loro differente termostabilità o la loro specificità di substrato. Il metodo più
impiegato è l’elettroforesi, data la differenza di carica eistente tra le
subunità H e M. Nei campioni di siero l’attività LDH rimane stabile per diversi
giorni a temperatura ambiente.
L’attività LDH sierica totale
è elevata in ogni patologia dove sia presente danno o morte cellulare e il suo
dosaggio costituisce un indicatore sensibile della esistenza di un qualche
processo patologico, anche se la mancanza di specificità può costituire uno
svantaggio per l’identificazione dell’organo interessato.
Si può avere un aumento del
livello sierico di lattico deidrogenasi totale in vari casi (in ordine
decrescente): anemia megaloblastica, metastasi carcinomatose, shock e condizioni
di ipossia, epatiti, infarto renale, miocardico, polmonare, condizioni associate
ad emolisi, leucemie, mononucleosi infettiva, distrofia muscolare, epatopatie,
ipotiroidismo, sindrome nefrosica, colangite.
I campioni di siero o di
altri liquidi organici da usare per determinare l’attività LDH non devono
presentare emolisi e devono essere rapidamente separati dai coaguli, perchè le
cellule ematiche possono rilasciare LDH. Le attività di tale enzima sono stabili
a temperatura ambiente, mentre sono danneggiate dal congelamento dei campioni.