PEPTIDI E LEGAME PEPTIDICO
Peptidi. I peptidi[E1][F1][E1]sono ammidi in cui due o più
a-amminoacidi sono
legati tra loro tramite legame peptidico. A seconda del numero di amminoacidi
che formano la molecola, essi vengono chiamati dipeptidi, tripeptidi e così via.
Per convenzione i peptidi con un peso molecolare inferiore a 10000 si chiamano
polipeptidi, oltre questo valore si chiamano proteine; tutte le
proteine sono quindi polipeptidi e presentano alcune loro caratteristiche
tipiche:
- gruppo amminico libero all’estremità N-terminale
- gruppo carbossilico libero all’estremità C-terminale
- gruppi ionizzabili (in genere debolmente acidi o basici)
sulle catene laterali di alcuni amminoacidi componenti la molecola
Queste caratteristiche fanno sì che il comportamento
chimico dei polipeptidi sia fortemente influenzato dalle condizioni del pH
circostante. Gli effetti del cambiamento di pH sono molto importanti in
biologia, in biochimica ed in particolar modo nella chimica delle proteine .
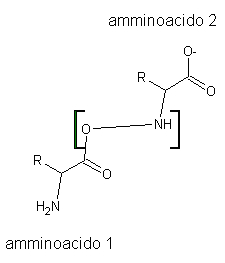
Legame peptidico. Il legame peptidico[E1] è un legame
covalente piuttosto forte che si forma tra il gruppo amminico ed il gruppo
carbonilico di due a-amminoacidi.
Studi a raggi X hanno mostrato che il legame peptidico
possiede alcune proprietà molto importanti per la struttura proteica:
- la conformazione del legame è quasi sempre trans
- i legami –C=O e –N–H sono quasi sempre paralleli
- attorno al legame C–N è possibile solo una piccola
torsione
- la lunghezza del legame C–N è inferiore rispetto al
normale legame semplice carbonio-azoto
Da queste osservazioni si deduce che il legame peptidico è
sostanzialmente piano, cioè che l’atomo di carbonio carbonilico, l’atomo di
azoto e i quattro atomi ad essi legati giacciono sullo stesso piano; inoltre si
intuisce il parziale carattere di doppio legame, che giustifica la sua elevata
forza.
Il legame peptidico si forma secondo la seguente equazione:
–NH2 +
–COOH <--> –NHCO– + H2O
In ambiente acquoso il legame tende ad idrolizzare con una
reazione estremamente lenta ed in assenza di catalizzatori è metastabile.
L’idrolisi, quindi la decomposizione delle proteine in polipeptidi più corti, è
ottenibile per mezzo di enzimi proteolitici, o proteasi.