|
Il XX secolo: i primi modelli atomici - concezione classica
4.1 Jean Perrin
Se i chimici aderirono entusiasticamente alla teoria atomica e molecolare, molto più cauti furono i fisici. Molti illustri fisici (quali Mach e Planck [F1]),
alla fine dell'Ottocento e ancora agli inizi del Novecento manifestarono un certo scetticismo nel confronti degli atomi.
La teoria atomica consentiva infatti la razionalizzazione di un'enormità di dati sperimentali, ma ciò che mancava per convincere gli ultimi scettici era una prova diretta della loro esistenza. Se non era possibile "vedere" direttamente gli atomi, doveva almeno essere possibile "contarli". La prova definitiva della possibilità di "contare" gli atomi venne fornita, agli inizi del XX secolo, proprio da Jean Perrin. In una serie di lavori pubblicati tra il 1900 e il 1911 Perrin dimostrò come fosse possibile "contare" gli atomi (determinazione del numero di Avogadro) e stabilire di conseguenza il valore di alcune grandezze atomiche assolute. Così ogni residuo dubbio sull'effettiva realtà di atomi e molecole venne definitivamente dissolto.
Ma qual è la struttura dell’atomo?
4.2 I tubi a raggi catodici - l’esistenza dell’elettrone
Verso la fine del XIX secolo l’attenzione dei fisici si rivolse al passaggio dell’elettricità nei gas. Da molti secoli era risaputo che nei gas, i quali in condizioni ordinarie sono ottimi isolanti elettrici, possono innescarsi scariche per effetto di alte tensioni elettriche. L’intensità delle scariche varia da piccolissime scintille (come quelle che si formano tra la maniglia di una porta e la mano di un uomo che cammina su un tappeto calzando scarpe di gomma) alle potenti scariche elettriche dei temporali. Ma sir William Crookes, il cui contributo alla scienza è solo parzialmente oscurato dalle sue credenze nel sovrannaturale e nello spiritismo, dimostrò che il passaggio dell’elettricità in un gas poteva aver luogo assai più facilmente a pressioni ben inferiori alla pressione atmosferica. I tubi di Crookes emanavano una tenue luminosità il cui colore dipendeva dalla natura del gas.
Quando la pressione del gas nel tubo al quale si applica l’alta tensione è sufficientemente bassa, appare un fascio molto sottile e definito diretto dal catodo all’anodo e, se lo sperimentatore fa in modo che l’anodo non lo intercetti, tale emanazione luminosa colpisce l’estremità del tubo di vetro. Il misterioso fascio emesso dal catodo colpendo la parte di vetro la illumina di luce diffusa verdastra e un oggetto qualsiasi posto sul suo percorso genera un’ombra netta. Avvicinando un magnete al tubo, Crookes notò che il fascio luminoso deviava dalla sua traiettoria allo stesso modo di una corrente elettrica o di uno sciame di particelle cariche elettricamente. Pressoché contemporaneamente il francese Jean Perrin scoprì che una lastra metallica interposta sul cammino del fascio si elettrizzava acquistando una carica negativa.
Tutte queste indagini sembravano indicare il passaggio di particelle di carica negativa attraverso un gas rarefatto, allo stesso modo in cui gli ioni di Faraday
[Es]
attraversavano i liquidi nel processo dell’elettrolisi. La differenza essenziale era naturalmente che, mentre nell’elettrolisi gli ioni dovevano farsi strada lentamente attraverso le molecole strettamente compresse del liquido e raggiungevano sempre, prima o poi, l’elettrodo opposto, i raggi catodici (come furono chiamati
[F1], [Es2]) procedevano nei gas in linea retta colpendo ogni ostacolo posto sul loro cammino.
Queste vedute furono strenuamente combattute dal fisico tedesco Philipp Lenard, il quale scoprì che i raggi catodici potevano facilmente attraversare diversi schermi posti sul loro cammino senza forarli come invece avrebbe fatto una qualsiasi particella materiale. Soltanto le onde elettromagnetiche, e non un fascio di particelle materiali, avrebbero potuto comportarsi in quel modo, concluse Lenard, i cui argomenti ci paiono oggi poco persuasivi, pensando alla difficoltà per schermare particelle ben più grandi di quelle costituenti i raggi catodici, come i neutroni. Ma a quel tempo gli argomenti di Lenard erano molto convincenti.
4.3 J.J.Thomson
L’incarico di chiarire le contraddizioni sperimentali dimostrando che i raggi catodici erano fasci di particelle e di determinarne le caratteristiche fu assegnato dal Supremo Consiglio per il Progresso della Scienza al fisico di Manchester Joseph John Thomson [I], più tardi Sir Joseph, che aveva allora quarant’anni e dirigeva il famoso Laboratorio Cavendish, uno dei maggiori centri di ricerca dell’epoca. Thomson, supponendo che i raggi catodici fossero particelle veloci, decise di misurarne la massa e la carica elettrica [F], [Es]. Una sicura fonte d’informazioni su queste quantità sarebbe stata la deflessione già osservata dei raggi catodici in un campo magnetico [F1] ,
[Es], [F2]. Infatti la deflessione dipende non solo dalla carica elettrica e dalla massa delle particelle, ma anche dalla loro velocità v; dalla misura di tale deflessione si poteva però solo ricavare il rapporto mv/e (m = massa raggi catodici, v = velocità raggi catodici, e = carica elettrica raggi catodici). La teoria però insegnava che la deflessione in un campo elettrico dipendeva da una diversa combinazione delle tre quantità, esattamente da mv 2/e; perciò, misurando entrambe le deflessioni e confrontandole, Thomson potè calcolare separatamente la velocità v di queste particelle e il rapporto tra la loro carica e la loro massa e/m; mentre però v risultava dipendere dalla differenza di potenziale applicata alle estremità del tubo, il rapporto e/m risultava costantemente uguale a 5,28 * 1017 u.e.s./g (u.e.s. = unità elettrostatica di carica elettrica), cioè 1,76 * 1011 C/kg. Sebbene sembrasse ormai certo che e dovesse avere lo stesso valore numerico della carica elettrica elementare scoperta da Faraday nei suoi esperimenti di elettrolisi nei liquidi, Thomson eseguì un particolare esperimento per misurare e nel caso degli ioni di un gas.
Successivamente Thomson, dal rapporto e/m, calcolò la massa di queste particelle e il risultato fu m = 9 * 10-28 g, cioè circa 1840 minore della massa dell’atomo di idrogeno.
Questa fu una grande scoperta : esisteva un particella circa 2000 volte più leggera del più leggero atomo conosciuto! Thomson concluse allora che, mentre gli ioni di Faraday erano atomi che trasportavano le cariche elettriche, i raggi catodici erano costituiti da cariche elettriche libere e diede a queste cariche il nome di elettroni [En].
4.4 Il nuovo modello atomico: "il Panettone"
A questo punto l’atomo venne considerato come un sistema complesso dotato di una struttura interna. Era quindi naturale cercare di elaborare qualche modello atomico che potesse interpretare i fatti sperimentali della fisica atomica. Logicamente ogni rappresentazione modellistica doveva tenere conto delle conoscenze acquisite a quel tempo, in particolare del fatto che:
- essendo ogni elemento di materia in condizioni normali elettricamente neutro un atomo doveva essere caratterizzato da una carica positiva uguale a quella negativa dei suoi elettroni
- essendo la massa atomica molto più grande di quella elettronica, la carica positiva doveva essere associata alla quasi totalità della massa dell’atomo
Sulla base di queste considerazioni si presentò dapprima il problema di stabilire il numero degli elettroni esistenti negli atomi degli elementi chimici conosciuti e di vedere poi come le cariche, equamente bilanciate, erano distribuite nell’edificio atomico.
Nei primi anni del XX secolo furono ideati vari modelli che, pur riuscendo a interpretare qualche risultato sperimentale erano incompleti e approssimati, soprattutto perché ogni modello era fondato solo sulla fisica classica.
Il modello di Thomson raffigurava l’atomo come una sfera materiale di raggio r= 10-10 m. Mentre la carica positiva, distribuita e diluita più o meno uniformante occupava tutta la sfera, gli elettroni, in numero tale da equilibrare la carica positiva dell’elemento considerato erano disseminati nella materia positiva come, l’uva di un panettone. Gli elettroni rimanevano in uno stadio di equilibrio nell’interno dell’atomo, in quanto erano soggetti ad un sistema di forze attrattive verso il centro dell’atomo, corrispondente al centro di simmetria della carica positiva, sia le mutue forze di repulsione, pure di natura elettrostatica agenti tra le cariche negative.
Secondo il modello di Thomson quando la materia acquista energia, gli atomi vengono eccitati e gli elettroni incominciano a vibrare come tanti oscillatori emettendo onde elettromagnetiche la cui frequenza è direttamente correlata con la frequenza delle particelle oscillanti.
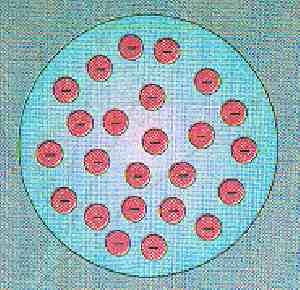
Modello atomico secondo Thomson. Gli elettroni rappresentati col simbolo (-) sono disseminati nella materia positiva diffusa nell’interno della sfera.
Furono eseguiti calcoli molto complicati nel tentativo di correlare le frequenze di vibrazione delle diverse configurazioni elettroniche con le righe spettrali osservate per vari elementi chimici, ma tutta questa fatica fu inutile e il problema restò insoluto fino alla comparsa del modello atomico di Rutherford.
4.5 Ernest Rutherford
Ernest Rutherford [Es], [I] nacque nel 1871 presso la città di Nelson nell’isola meridionale della Nuova Zelanda e quando, molti anni dopo, per i suoi meriti scientifici ricevette un titolo nobiliare britannico, diventò Lord Rutherford di Nelson. A 24 anni andò a Cambridge per studiare sotto la guida di J.J.Thomson al Laboratorio Cavendish e, dopo essersi laureato, fu nominato professore incaricato presso l’Università McGill di Montreal, dove eseguì importanti ricerche sul fenomeno della radioattività [I]
[En]
[F1]
[F2]
[Es]
da poco scoperto. Successivamente si trasferì all’Università di Manchester e nel 1919, dopo il ritiro di J.J. Thomson, divenne direttore del Laboratorio Cavendish.
Una curiosità: Rutherford era chiamato dai colleghi ‘Coccodrillo’, nomignolo affibbiatogli da uno dei suoi allievi preferiti, il fisico russo Peter Kapitza. Va notato che, mentre per gli Inglesi che si recavano spesso in Egitto e venivano morsicati o divorati dai coccodrilli questo soprannome era piuttosto offensivo, per i Russi, che non erano abituati a vedere i coccodrilli nella loro terra natìa, esso rappresentava un simbolo di notevole forza e vigore. Anche se nessuno osava mai pronunciare quel soprannome in sua presenza, Rutherford ne era al corrente e ne era anche segretamente orgoglioso.
Tornando agli anni trascorsi da Rutherford a Manchester, egli non era troppo convinto del modello ‘ad anguria’ (o ‘a panettone’) dell’atomo di Thomson e decise di indagare sulle caratteristiche strutturali interne degli atomi, bombardandolo con il nuovo tipo di proiettili capitati a portata di mano dei fisici dopo la scoperta della radioattività. "Non ho la possibilità di vedere gli atomi - pensò Rutherford - poiché sono troppo piccoli; tanto meno posso andare a frugare nel loro interno; però potrei trovare un mezzo capace ugualmente di dare una risposta agli interrogativi riguardanti la costituzione interna dell'edificio atomico."
Se si lancia una palla contro un ostacolo, da come essa rimbalza e dagli spostamenti della sua traiettoria si possono trarre interessanti conclusioni sull'architettura dell'ostacolo stesso. Se la palla incontra per esempio una superficie liscia e rigida rimbalzerà indietro con veemenza, secondo un certo angolo; se l'ostacolo, invece, fosse una rete dondolante, la palla non rimbalzerebbe, ma cadrebbe nel punto d'incontro; se la parete fosse sforacchiata la palla potrebbe passare oltre senza rimbalzare.
Rutherford pensò di sfruttare proprio questo principio allo scopo di studiare la composizione degli atomi.
4.6 La fase sperimentale di Rutherford
Durante i primi anni trascorsi all’Università McGill, Rutherford aveva messo in evidenza il fatto che le cosiddette particelle alfa [En]
[Es], emesse da vari elementi radioattivi, non sono altro che fasci di ioni di elio carichi positivamente emessi ad altissima energia da atomi instabili. Durante l’interazione con le particelle cariche dell’atomo le particelle alfa devono essere deviate dalla loro traiettoria originaria e la conseguente diffusione del fascio deve fornire informazioni sulla distribuzione della cariche elettriche all’interno degli atomi. Egli avrebbe lanciato le particelle alfa (vengono emesse da alcune sostanze radioattive con una velocità di 107 m/s, sicché possono attraversare sottili strati di materia) come proiettili contro un nutrito gruppo di atomi e sarebbe stato a vedere in che modo essi avrebbero risposto.
A quei tempi il conteggio di particelle richiedeva una procedura laboriosissima : mentre in tempi più recenti (ma anche oggi) un fisico poteva mettere in funzione un contatore Geiger e andare a fare qualsiasi altra cosa, anche una passeggiata, Rutherford doveva osservare con un microscopio uno schermo fluorescente posto sul cammino del fascio e contare a occhio nudo le scintillazioni prodotte sullo schermo dall’urto di ogni particella alfa. Alcuni fisici nucleari dell’epoca ingoiavano belladonna per dilatare maggiormente la pupilla.
Per il suo esperimento Rutherford aveva bisogno di una adeguata palestra per questo eccezionale tiro al bersaglio; poi gli occorreva un "cannone" che sparasse i "proiettili" adatti; infine doveva provvedere al bersaglio ed al sistema di osservazione. Ed ecco come Rutherford costruì il primo "campo di tiro atomico" della storia.
Prese un campione di radio, lo rinchiuse in una capsula di piombo, munita di un piccolo foro. Le particelle Alfa sparate dal radio a grande velocità e quindi dotate di una notevole forza d'urto sarebbero passate dal foro in linea retta.
Poi sistemò tutto dentro un bulbo di vetro, dal quale pompò via l'aria. Infine pose dinanzi alla capsula che funzionava da "cannone" atomico, uno schermo fluorescente applicato ad un microscopio.
Sullo schermo, nel punto colpito dalle particelle Alfa, apparve agli occhi dello scienziato un vivace scintillio. Era il segnale che i proiettili sparati dal radio arrivavano proprio in linea retta e che lungo il cammino non avevano incontrato alcun ostacolo. Era la prova del tiro. L'osservatorio si dimostrava buono; non mancava che il bersaglio. Rutherford pensò che un buon ostacolo per i suoi proiettili sarebbero stati gli atomi d’oro. Questi infatti mostravano un
peso ben 197 volte maggiore di quelli dell'idrogeno perciò potevano considerarsi abbastanza consistenti da deviare e respingere i proiettili Alfa del "cannone" atomico.
Lo scienziato prese una sottile lamina di questo prezioso metallo e la mise fra il radio ed il suo schermo, quindi tornò al suo posto d'osservazione. Quello che vide lo riempì di meraviglia. Sullo schermo fluorescente appariva lo stesso scintillio di prima. Le particelle Alfa attraversavano la lamina d'oro senza subire alcun effetto. I suoi proiettili atomici continuavano a raggiungere lo schermo come se l'ostacolo posto sul loro percorso non fosse nemmeno esistito.
Eppure, per quanto sottile, quel bersaglio era, da un punto di vista atomico, una muraglia di spessore eccezionale. In quella lamina d'oro c'erano tanti atomi che, se si fossero ingranditi ciascuno fino alle dimensioni di una palla da biliardo, l'ostacolo attraversato dalle particelle Alfa avrebbe avuto uno spessore di oltre cento metri. Come poteva una barriera di questo genere essere attraversata con tanta facilità?
Mentre Rutherford rimuginava su questo interrogativo, provò a cambiare posizione al suo osservatorio. Fino a quel momento, egli lo aveva mantenuto proprio di fronte al forellino della capsula contenente il radio, cioè in linea retta davanti alla bocca del suo eccezionale "cannone". Spostando lo schermo di lato, Rutherford venne a trovarsi con il suo oculare fuori dal campo di tiro; infatti, quando accostò l'occhio al microscopio, vide tutto scuro. Però in alcuni punti appariva qualche lampeggiamento. Incuriosito ed affascinato dallo spettacolo, cambiò ancora posizione allo schermo, sistemandolo ad angolo retto rispetto al fascio dei raggi Alfa, proprio di fronte al bordo della lamina d’oro.
Anche questa volta lo studioso assisté alla visione di rari lampeggiamenti in varie zone dello schermo buio. La stessa cosa, ma con minore frequenza, gli capitò di vedere anche quando sistemò il suo osservatorio dietro la sorgente di raggi Alfa.
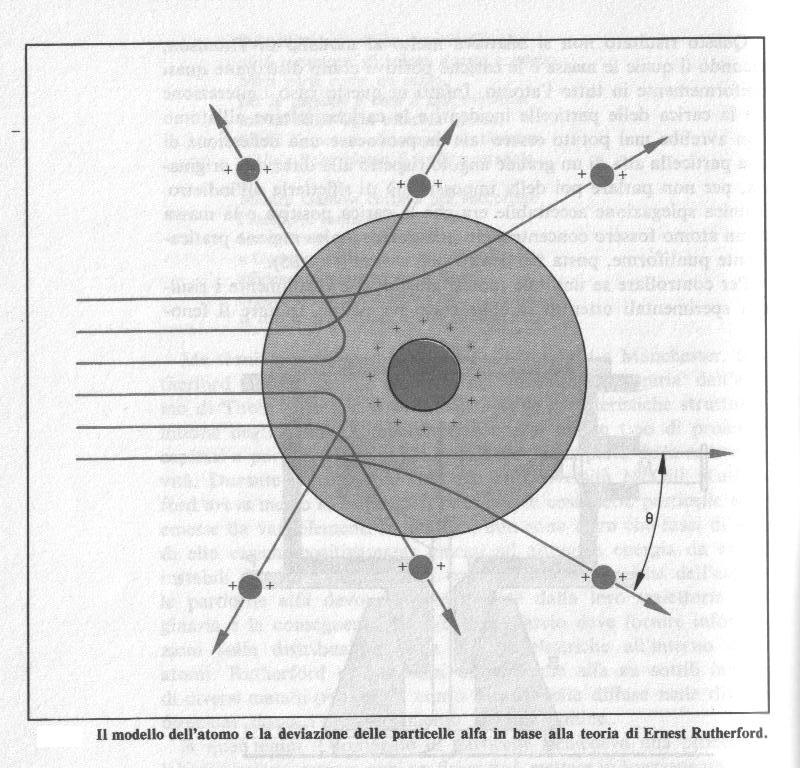
Dunque il risultato degli esperimenti di Rutherford fu che la diffusione delle particelle alfa attraverso sottili lamine metalliche era considerevole e, sebbene un gran numero di particelle del fascio incidente mantenesse la propria direzione originaria, almeno altrettante venivano deflesse di molti gradi e alcune erano addirittura riflesse all’indietro.
4.7 L’interpretazione dei risultati
Questo risultato non si adattava molto al modello di Thomson, secondo il quale le masse e le cariche positive erano distribuite quasi uniformemente in tutto l’atomo. Infatti in questo caso l’interazione tra la carica delle particelle incidenti e le cariche interne dell’atomo non avrebbe mai potuto esser tale da provocare una deflessione di una particella alfa di un grande angolo rispetto alla direzione originaria, per non parlare poi dell’impossibilità di rifletterla all’indietro.
A questi fenomeni si poteva dare una spiegazione. Il fatto che i proiettili di Rutherford potessero attraversare l'enorme barriera degli atomi dell'oro con così grande facilità, significava questo: gli atomi (ritenuti fino allora piccole sfere "solide ed impenetrabili"), non offrivano alcuna resistenza al passaggio delle particelle Alfa; si comportavano come se fossero involucri vuoti, praticamente privi di qualunque consistenza.
I lampeggiamenti laterali rivelarono un'altra verità. Non tutte le particelle Alfa passavano impunemente attraverso gli atomi dell'oro; qualcuna incontrava un ostacolo e veniva rimbalzata, ora da un lato, ora dall'altro, ora addirittura indietro, a seconda della posizione del bersaglio colpito e della traiettoria dei proiettili.
Rutherford fece anche un conteggio delle particelle che rimbalzavano rispetto a quelle che invece proseguivano il loro percorso. Trovò un risultato sorprendente: soltanto un proiettile su ottomila colpiva un bersaglio che lo deviava o lo faceva rimbalzare indietro. Lo scienziato, da questi esperimenti, poté trarre due conclusioni: gli atomi non sono completamente vuoti, altrimenti tutte le particelle Alfa, nessuna esclusa, avrebbero attraversato la lamina senza intoppi. Gli atomi dovevano invece contenere nel loro interno qualche cosa, una specie di "nocciolo" così duro e solido da respingere indietro i proiettili.
La seconda conclusione fu questa: il nocciolo degli atomi, o per chiamarlo con il nome stesso con cui lo individuò Rutherford, il nucleo, doveva essere estremamente piccolo rispetto alle dimensioni dell'atomo che lo conteneva, tanto piccolo che le probabilità di colpirlo erano soltanto una su ottomila. Ernest Rutherford riuscì a calcolare questa estrema piccolezza: il diametro del nucleo può essere anche 50 mila volte più piccolo di quello dell'atomo che lo contiene.
C'era da impazzire. Un atomo, nel suo insieme, ha le dimensioni dell’angstrom (10-10 m). Per coprire la distanza di due centimetri occorrerebbero non meno di cento milioni di atomi, l'uno accanto al l'altro. Ora il nucleo dimostrava di avere un volume almeno mille volte più piccolo di quello di tutto l'atomo.
Vinto il primo stupore suscitato da tali misure, una meraviglia più grande colpì la mente degli scienziati. Di fronte alla inimmaginabile piccolezza dei nuclei, gli atomi diventavano addirittura giganteschi. Per avere un'idea, basta immaginare di ingrandire il nucleo fino alle dimensioni di una palla da biliardo. Rispetto a questa proporzione l'atomo diventerebbe un pallone di cento metri di diametro.
Ma allora, che cosa c'è fra il nucleo e l'involucro atomico esterno? Nulla: il vuoto.
4.8 La sezione d’urto del nucleo atomico
Il nocciolo atomico, dopo ciò che si è detto, rivelò anche un'altra importantissima dote: esso risultò carico di elettricità positiva. Le cariche elettriche di segno contrario si attraggono con grande forza, mentre quelle di segno uguale si respingono violentemente. Ecco, infatti, cosa avveniva ai proiettili positivi sparati dal radio contro gli atomi dell'oro.
Quando le pallottole si avvicinavano ai nuclei, la forza elettrica positiva di questi le faceva deviare. Se per caso uno dei proiettili raggiungeva il bersaglio nucleare proprio in direzione del centro, allora la pallottola veniva "frenata" e fermata prima che toccasse il nucleo e quindi costretta a rimbalzare in dietro, con eccezionale violenza, dalla forza elettrica repulsiva. Ecco la vera ragione dei rimbalzi nel campo di tiro atomico di Rutherford.
Dunque l’unica spiegazione accettabile era che la carica positiva e la massa di un atomo fossero concentrate in una microscopica regione di spazio praticamente puntiforme, posta nel centro dell’atomo.
 Per controllare se una tale ipotesi giustificasse esattamente i risultati sperimentali ottenuti sarebbe stato necessario trattare il fenomeno secondo le leggi della meccanica classica e ricavare una formula che esprimesse la deflessione subita dalle particelle che passavano a varie distanze dal centro di repulsione.
Per controllare se una tale ipotesi giustificasse esattamente i risultati sperimentali ottenuti sarebbe stato necessario trattare il fenomeno secondo le leggi della meccanica classica e ricavare una formula che esprimesse la deflessione subita dalle particelle che passavano a varie distanze dal centro di repulsione.
Secondo la formula di Rutherford, il numero di particelle alfa deviate di un angolo t dalla traiettoria originale è inversamente proporzionale alla quarta potenza di sen(t/2), conclusione questa in perfetto accordo con le curve di diffusione osservate sperimentalmente. Per l’esattezza,
ds/da = (2Ze2/mv2)2 1/sin4(t/2) (sezione d’urto di Rutherford)
dove
- e carica elettrica
- m massa delle particelle alfa
- v velocità delle particelle alfa
- Z numero atomico del bersaglio
- t angolo di deflessione
- a angolo solido sotteso dallo schermo visto dal bersaglio
- s sezione d’urto (n° particelle diffuse in da al secondo/ n° particelle incidenti su cm2 al secondo)
La massa del nucleo è considerata infinita rispetto a m.
Quando nel 1911 lo scienziato neozelandese, allora professore all'università di Manchester, annunciò al mondo le sue scoperte, le vecchie teorie atomiche della fisica e della chimica crollarono. I modelli atomici, tanto faticosamente architettati per spiegare la composizione e la struttura della materia, diventarono inservibili. Occorreva ricominciare da capo.
Le prime domande che si posero gli studiosi, dopo gli esperimenti di Rutherford, furono queste: di che cosa è fatto l'involucro esterno degli atomi? Perché questa specie di guscio si lascia così facilmente attraversare dai proiettili Alfa, mentre in molte altre circostanze si presenta duro e impenetrabile come ad esempio in un cristallo?
A tali interrogativi fu risposto in breve tempo, sia dallo stesso Rutherford sia ad opera del fisico danese Niels Bohr [Es], [F].
4.9 Il modello atomico “a planetario” di Rutherford
Il modello di Rutherford suppone che l'atomo si comporti come un minuscolo sistema planetario. Al centro, il nucleo che raccoglie quasi tutta la massa e tutta la carica positiva dell'atomo; intorno al nucleo ruotano gli elettroni, dotati di carica elettrica negativa. La forza che lega elettroni rotanti e nucleo è una forza elettrica che, nell'analogia con il sistema planetario, corrisponderebbe alla forza gravitazionale [F]. Questa forza è inversamente proporzionale al quadrato della distanza, proprio come la legge di Newton.
Con quel modello, si poteva spiegare la successione degli elementi classificati nella tavola di Mendeleev e si poteva stabilire un valore del peso atomico, nonché il numero degli elettroni caratteristici di ciascun atomo dei novantadue elementi. Per Rutherford la caratteristica fondamentale di un atomo è il valore della carica elettrica del suo nucleo, cioè il suo numero atomico (assunta come unità la carica dell'atomo più semplice, quello dell'idrogeno). La carica determina il numero degli elettroni che orbitano intorno al nucleo e di conseguenza le proprietà chimiche di ciascun elemento.
[En1], [En2].
Sulla base del modello descritto, le proprietà chimiche e fisiche di un atomo dipendono dal numero e dal movimento degli elettroni. Le reazioni chimiche normali avvengono nell’ambito degli elettroni; il nucleo non viene mai coinvolto in questi fenomeni. Il nucleo è interessato quando si passa alle proprietà radioattive: la radioattività è connessa al nucleo ed è svincolata da ogni rapporto con gli elettroni-satelliti.
Ma questo modello incominciò subito a sollevare problemi non appena proposto.
Applicando all'atomo di Rutherford le leggi classiche della teoria elettromagnetica, si giunse alla conclusione che gli atomi avrebbero dovuto essere sistemi estremamente instabili (fatto inconciliabile con l'esistenza stessa della materia che forma il nostro mondo). Infatti, la fisica tradizionale aveva stabilito che un corpo carico di elettricità e soggetto a un'accelerazione irradia continuamente energia. L'elettrone si trova appunto in questa condizione: ruotando intorno al nucleo dovrebbe irradiare energia e quindi perderla continuamente. Ciò comporterebbe il passaggio a orbite sempre più vicine al nucleo e quindi alla caduta dell'elettrone sul protone.
Le discordanze fra il modello e la realtà non si fermavano qui. Dalla spettroscopia [En] [Es]
(derivata dalle prime ricerche di Newton) si sapeva che ogni elemento emette spettri caratteristici [En]
[I] [F]; in altre parole si era vista la possibilità di radiazioni in frequenze costanti. Ma ciò non sarebbe possibile se l'atomo fosse stato sic et simpliciter quello di Rutherford; infatti, se l'elettrone perdesse costantemente energia fino a cadere nel nucleo dovrebbe emettere tutte le frequenze possibili comprese nel passaggio dal suo livello massimo di energia a quello minimo. Gli spettri, in questo caso, non permetterebbero di identificare i vari tipi di atomi come invece consentono: ogni banda dello spettro corrisponde ad un elemento.
Le ordinarie leggi della meccanica e dell'elettromagnetismo non si conciliavano con il modello di Rutherford. Ecco il problema che stimolò le ricerche in ogni direzione. Da queste indagini nacque, fra l'altro, una teoria che ebbe enormi sviluppi: la teoria dei quanti. [F] [Es]
 5/6
5/6

|