|
Trattamenti chimici
Trattamenti chimici. (F1)(F2)(E)(ES) (I).
L’ uso dei prodotti chimici per il trattamento delle
acque è stato in un primo tempo usato per le acque grezze, in particolare per
abbattere la durezza dell’ acqua, successivamente in seguito al grande sviluppo
industriale, bisognava utilizzare prodotti chimici per modificare le
caratteristiche delle acque di scarico che non potevano essere scaricate nei
fiumi.
Neutralizzazione
Sia per le acque di primo impiego, sia per il
riciclo o lo scarico delle acque reflue, si richiede un valore di pH (I1)
(I2)
circa uguale a 7; per le acque industriali, ad evitare corrosioni, si
preferisce avere una debole alcalinità ( per esempio per l’ acqua di
raffreddamento si tiene un pH tra 7,3 e 8,3).
Nei trattamenti di potabilizzazione, per
neutralizzare l’ acidità si usa generalmente latte di calce che ha anche la funzione di coadiuvare i
trattamenti di coagulazione e di trasformare in composti insolubili i
bicarbonati di calcio e magnesio.
Nei trattamenti di deacidificazione degli effluenti
si usa,oltre al latte di calce, idrato di calce in polvere ed a volte si fa
passare il liquido su pezzi di calcare; in questo caso occorre che, se presente
acido solforico, la concentrazione non sia troppo elevata, altrimenti sulla
superficie dei pezzi si deposita del solfato di calcio, che impedisce la
reazione.
La neutralizzazione dell’ alcalinità viene attuata
con l’ impiego di acido solforico o di acido cloridrico.
Ossidazione (F)
L’ossidazione ha lo scopo di eliminare sostanze (i
solfuri che possono essere ossidati a solfati, i cianuri che possono essere
ossidati ad azoto e biossido di carbonio ed eliminati come gas), presenti nell’
acqua grezza o nelle acque reflue, trasformandole in altre che non sono dannose
o allontanandole.
Come prodotti ossidanti si usano Cl2,
KMnO4, O3, ClO2, Ca(ClO)2, NaOCl:
il cloro ed i cloroderivati sono preferibili come ossidanti, sia per ragioni
economiche, sia per la facilità di impiego.
Il trattamento di ossidazione, sia con cloro o
cloroderivati, (E) è utilizzato alla depurazione delle
acque contenenti sostanze sia inorganiche che organiche; il procedimento va
sotto il nome di clorazione.(F)(ES)(I)
La clorazione svolge sia un’ azione ossidante , sia
un’ azione bioacida, azione rivolta alla distruzione di alghe e batteri.
Il cloro gassoso, che si trova in commercio a 5-10
atm, viene fatto gorgogliare nell’ acqua da trattare, dosandolo in modo che si
abbia un leggero eccesso rispetto allo stechiometrico.
Con l’acqua il cloro reagisce secondo la reazione:
Cl2 + H2O 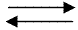 HCl +HClO
(1) HCl +HClO
(1)
Si ha una reazione di equilibrio, che decorre verso
destra a pH> 5; inoltre l’HClO formatosi si decompone secondo la
reazione:
HClO  HCl + O.
(2) HCl + O.
(2)
questo si verifica con valori di pH intorno a 6, si
ottiene ossigeno atomico molto attivo, mentre con valori tra 6 e 9 si ha la
formazione di ioni ClO-
HClO  H+
+ ClO- (3) H+
+ ClO- (3)
L’azione disinfettante del cloro viene interpretata
in vari modi: (E)
a) azione ossidativa verso la
cellula batterica da parte dell’ ossigeno della reazione ( 2 );
b) azione degli ioni ClO- sulle proteine che costituiscono la
membrana, il protoplasma ed il nucleo della cellula con distruzione di quest’
ultima e la morte dei microrganismi;
c) penetrazione degli ioni ClO-
, attraverso la membrana cellulare
senza alterazioni della membrana e del nucleo, con profonde alterazioni dei
processi di nutrizione e riproduzione dei batteri.
La quantità indicativa di cloro che viene usata nei
processi di clorazione, è riportata in Tabella n.1
Processi di clorazione:
quantità indicativa di cloro impiegata
|
Processo
|
Cloro impiegato
|
|
Ossidazione sostanze
organiche
|
11,7 ppm per 1 ppm di C
presente
|
|
Ossidazione H2S
a S
|
2,1 ppm per 1 ppm di H2S
|
|
Ossidazione H2S
a SO2
|
0,3 ppm per 1 ppm di H2S
|
|
Ossidazione CN- a
N2 + CO2
|
6,9 ppm per 1 ppm di CN-
|
|
Potabilizzazione
|
1,6 ppm per 1 ppm di sostanze ossidabili
|
Il cloro in presenza di sostanze organiche porta
alla formazione di cloroderivati, per esempio clorofenoli se sono presenti
fenoli, che possono impartire all’acqua un sapore disgustoso.
Terminata la clorazione, per eliminare il cloro
residuo che darebbe all’acqua un gusto molto sgradevole, si compie la
declorazione per trattamento con sostanze riducenti, come carbone attivo,
iposolfito di sodio e anidride solforosa.
Facendo passare l’acqua attraverso un letto di
carbone attivo, avviene la riduzione del cloro:
C + 2Cl2 + 2H2O  CO2 + 4 HCl CO2 + 4 HCl
L’iposolfito agisce secondo le seguenti reazioni:
Na2S2O3 + 5H2O
+ 4Cl2  Na2SO4
+ H2SO4 + 8HCl Na2SO4
+ H2SO4 + 8HCl
Na2S2O3 + H2O
+ Cl2  Na2SO4 +
2HCl + S Na2SO4 +
2HCl + S
Per quantità di cloro inferiore a 10 kg al giorno,
invece del cloro gassoso si possono impiegare:
 ipoclorito di calcio Ca(ClO)2 ;
ipoclorito di calcio Ca(ClO)2 ;
 ipoclorito di sodio NaClO viene utilizzato solo per piccoli impianti;
ipoclorito di sodio NaClO viene utilizzato solo per piccoli impianti;
 biossido di cloro ClO2 viene impiegato negli impianti di
potabilizzazione ed è preparato sul posto, attraverso la reazione del clorito
di sodio con cloro:
biossido di cloro ClO2 viene impiegato negli impianti di
potabilizzazione ed è preparato sul posto, attraverso la reazione del clorito
di sodio con cloro:
2 NaClO2 + Cl2  2ClO2 + 2
NaCl 2ClO2 + 2
NaCl
Sebbene il processo sia difficile da controllare, il
ClO2 viene usato per la forte azione disinfettante e perché non
provoca reazioni che portano a composti di cattivo sapore ed odore.
Un altro ossidante che serve per la disinfezione e
per allontanare molte sostanze che impartiscono colorazione ed odore, è l’ozono
(I) , che è
particolarmente efficace nell’ ossidazione dei fenoli e dei cianuri.
La preparazione dell’ ozono, per scarica elettrica
in un flusso di aria, avviene secondo la seguente reazione:
3 O2  2 O3 deltaH = + 68000 cal ( 285000 j) 2 O3 deltaH = + 68000 cal ( 285000 j)
L’aria così trattata ha una forte azione ossidante
perché l’ ozono, in presenza di sostanze riducenti Red, fornisce ossigeno
atomico molto attivo che le ossida
O3 + Red  O2 + Red ·O O2 + Red ·O
il processo è usato per piccoli impianti di
trattamento di effluenti industriali e per la disinfezione delle acque di
impianti sanitari, piscine e simili.
Per la potabilizzazione di acqua, in impianti
occasionali e mobili ( per esempio cantieri e reparti militari) si usa KMnO4
e derivati clorurati dell’ ammoniaca, cioè le cloroammine e le cloroammidi che
si ottengono attraverso le seguenti reazioni:
Cl2 + 2NH3  NH4Cl
+ NH2Cl NH4Cl
+ NH2Cl
monocloroammina
2Cl2 + 3NH3  2NH4Cl
+ NHCl2 2NH4Cl
+ NHCl2
dicloroammina
Questi composti vengono
disciolti in acqua al momento dell’ uso e si decompongono dando HClO secondo la
reazione:
NH2Cl + H2O  HClO + NH3 HClO + NH3
Coagulazione.
Nell’ acqua grezza e nelle acque reflue, provenienti
sia dagli scarichi urbani che industriali, possono trovarsi sostanze diverse
come:
 sospensioni di sabbie, argille, composti chimici, ecc;
sospensioni di sabbie, argille, composti chimici, ecc;
 emulsioni di oli, grassi, idrocarburi ecc;
emulsioni di oli, grassi, idrocarburi ecc;
 sostanze organiche ed inorganiche in soluzione colloidale;
sostanze organiche ed inorganiche in soluzione colloidale;
 sostanze varie in soluzione.
sostanze varie in soluzione.
La separazione per
sedimentazione è possibile per le sostanze in sospensione grossolana che richiedono tempi abbastanza brevi (
massimo 3-4 ore), non si può attuare per le sostanze in sospensione finissima,
come per certi tipi di argilla e per certi precipitati chimici ed in generale
per tutte le particelle che hanno diametro inferiore a 10 micron.
La separazione delle
sostanze colloidali è impossibile, a meno che non si provochi una coagulazione
(detta anche impropriamente flocculazione).
Si chiama flocculazione il fenomeno che consiste
nell’aumento delle dimensioni delle particelle disperse colloidalmente nella fase acquosa,
per effetto dell’addensamento delle singole particelle a formare fiocchi di
maggiori dimensioni.
La coagulazione si ottiene
aggiungendo all’acqua sostanze chimiche che provocano un’alterazione delle
forze che tendono a tener disperse le particelle: con l’aggiunta di alcuni
composti chimici si provocano i fenomeni della coagulazione, della flocculazione
e della sedimentazione.
I colloidi (I)
rispetto all’ acqua presentano una natura idrofila o idrofoba e perciò la
stabilità della dispersione in acqua dipenderà da fattori differenti.
La stabilità di un colloide
idrofilo dipende dall’ idratazione superficiale delle particelle, che crea una
barriera che si oppone al contatto di una particella con l’ altra.
La stabilità di un colloide
idrofobo dipende dalla carica elettrica superficiale posseduta da ogni
particella e che è dovuta sia alla presenza di gruppi ionici disposti alla sua
superficie, sia all’adsorbimento di ioni dal mezzo nel quale si trova
disperso.
I coagulanti: (F) (E)
Aggiungendo un elettrolita ad una sospensione
colloidale, si rompe la sua stabilità ed agitando, aumenta la possibilità di
incontro delle particelle, che a contatto avvenuto tenderanno ad aggregarsi
sempre di più, aumentando le dimensioni dell’ aggregato in funzione delle forze
di coesione.
L’ insieme del fenomeno di
precipitazione delle sostanze colloidali idrofobe in una sospensione acquosa,
si distingue nelle varie fasi:
 coagulazione dovuta alla variazione delle forze elettrostatiche
ottenuta per aggiunta di un elettrolita;
coagulazione dovuta alla variazione delle forze elettrostatiche
ottenuta per aggiunta di un elettrolita;
 flocculazione dovuta a forze di Van der Waals;
flocculazione dovuta a forze di Van der Waals;
 sedimentazione dovuta alla forza di gravità.
sedimentazione dovuta alla forza di gravità.
Per favorire la precipitazione
di sostanze in sospensione di tipo colloidale si possono effettuare i seguenti
accorgimenti:
 correzione del pH mediante aggiunta di alcali;
correzione del pH mediante aggiunta di alcali;
 aggiunta di un coagulante per esempio Al2(SO4)3
con agitazione veloce;
aggiunta di un coagulante per esempio Al2(SO4)3
con agitazione veloce;
 aggiunta di ausiliari di coagulazione per esempio SiO2 per
favorire l’ accrescimento del fiocco ed agitazione lenta.
aggiunta di ausiliari di coagulazione per esempio SiO2 per
favorire l’ accrescimento del fiocco ed agitazione lenta.
Molti possono essere i
coagulanti sia di natura inorganica che organica, con ioni di carica opposta a
quelle delle particelle.
Il potere coagulante aumenta con l’ aumentare del
rapporto carica / raggio dello ione: il KCl ha un potere coagulante molto
inferiore rispetto al Al2(SO4)3
, quindi il cloruro di potasio non viene usato come coagulante.
A volte gli agenti coagulanti reagiscono con
sostanze in soluzione, facendole precipitare insieme alle sostanze colloidali.
I sali di ferro e di alluminio sono stati i primi
prodotti impiegati come agenti coagulanti; usati sia per le acque grezze
destinate ad uso industriale e potabile, sia nel trattamento di acque reflue
industriali ed urbane.
I coagulanti più diffusi
sono i policloruri di alluminio, il solfato di alluminio, il cloruro ferrico,
il solfato ferroso, l’ alluminato di sodio e l’ idrossido di calcio. Un’
aggiunta di questi elettroliti a una soluzione contenente particelle di natura
colloidale determina diversi effetti, che permettono di effettuare la
chiarificazione.
I sali indicati, per elementari reazioni chimiche,
si trasformano nei relativi idrossidi, a basso prodotto di solubilità.
FeCl3
+ H2O  Fe(OH)3 + 3HCl Fe(OH)3 + 3HCl
Mantenendo il pH del sistema ad un valore che non
permetta la ridissoluzione degli idrossidi, questi formano un letto filtrante
che scendendo trascina con sé altre particelle.
Bisogna tener presente che a questi effetti vanno
aggiunti gli effetti di adsorbimento di certi ioni e composti sulla superficie
dei fiocchi gelatinosi ed anche effetti chimici di precipitazione per
formazione di sali insolubili, quali i fosfati di ferro.
Gli ausiliari di coagulazione. (I1) (I2).
Si possono
inserire molti gruppi nella catena polimerica, ottenendo dei polielettroliti
con notevole potere coagulante, le quantità usate sono molto esigue 1 ppm,
perciò vengono considerati ausiliari di coagulazione piuttosto che agenti
coagulanti.
La chiariflocculazione è facilitata da piccole
aggiunte di ausiliari di coagulazione, di poco successiva a quella del
coagulante. Gli ausiliari possono essere sia inorganici (silice attivata,
bentonite) sia, più frequentemente, poilelettroliti organici di tipo cationico,
o anionico.
Si tratta di polimeri organici sintetici, solubili
in acqua o ben disperdibili, caratterizzati dalla presenza di gruppi carichi o
almeno polari lungo tutta la catena.
I polielettroliti sono divisi in due gruppi:
a) quelli che possiedono un
carattere fortemente ionico e che con la loro carica neutralizzano la carica
della particella, riducendo le forze di repulsione che impediscono alle
particelle di aggregarsi;
b) quelli che per la lunghezza
delle catene polimeriche possono dar luogo a fenomeni di adsorbimento con le
particelle.
I polielettroliti anionici sono polimeri derivati
dall’ acido acrilico per esempio le poliacriloammidi
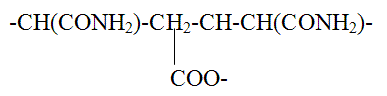
Polielettroliti cationici sono, per esempio i sali
quaternari di polivinilpiridinio.
La presenza di opportune
cariche o di gruppi polari uniformemente distribuiti lungo la catena facilita l’
aggregazione alla catena di microfiocchi già formati, formando dei fiocchi di
maggiore dimensione.
Scambio ionico
A volte è necessario avere nell’ acqua un contenuto
di ioni praticamente nullo, per esempio nell’ acqua di alimentazione delle
caldaie ad alta pressione, si può ricorrere al trattamento con scambiatori di
ioni. Con questo termine si intendono le sostanze naturali e sintetiche, che
hanno proprietà di scambiare i propri ioni con quelli contenuti nell’ acqua.
L’ addolcimento di un’ acqua mediante lo scambio di
ioni Ca2+ e Mg2+ con ioni Na+ mediante l’ uso
di materiali naturali, come le zeoliti, costituiti da allumino-silicati che
contenevano ioni Na+ che potevano essere scambiati con ioni Ca2+
e Mg2+ .
I vantaggi ottenuti hanno indotto molti studiosi a
ricercare dei materiali sintetici con prestazioni migliori delle zeoliti
naturali.
Le zeoliti sintetiche pur avendo una buona capacità
di scambio, perdevano abbastanza velocemente le loro proprietà; inoltre sia
quelli naturali che quelle sintetiche possono scambiare solo cationi, mentre
spesso bisogna allontanare anche gli anioni. Per questi motivi vennero
abbandonate e si utilizzarono le resine.
Nel 1935 Adams ed Holmes in Gran Bretagna,
sintetizzarono le prime resine a scambio ionico, attraverso la
policondensazione della formaldeide con i difenoli; successivamente gli stessi
ricercatori ottennero resine con carattere molto più acido inserendo gruppi
solfonici. Sono dei polimeri organici insolubili, normalmente sotto forma di
minuscole sfere, nella cui catena sono inseriti gruppi funzionali con
caratteristiche di acido o di base.
Si ottennero
resine cationiche, capaci di scambiare ioni con carica positiva; resine
anioniche, capaci di scambiare ioni con carica negativa.
Il fenomeno è regolato dalla legge dell’azione di
massa ed è reversibile.
- Una tipica resina scambiatrice cationica forte è
un polistirene con un certo numero di gruppi solfonici –SO3H ,
possiede un reticolo con cariche negative e ioni mobili - controioni – con
carica positiva capaci di scambiarsi con altri ioni della stessa polarità.
Una resina solfonica sarà così rappresentata:
[ R-SO3]- H+
Se sulla resina si fa passare acqua dura, cioè
contenente ioni calcio, la resina li cattura scambiandoli con la quantità
stechiometrica di idrogenioni. Quando la capacità di scambio della resina è
esaurita, trattandola con una soluzione di acido forte ( per esempio HCl al 10%
) lo scambio avviene in senso inverso e si verifica la rigenerazione.
Le resine scambiatrici cationiche forti possono operare
sia in ciclo idrogeno, sia in ciclo sodico.
Il ciclo idrogeno è quello precedentemente
descritto; nel ciclo sodico la resina lavora sotto forma di solfonato sodico,
scambiando ioni sodio con ioni calcio e la rigenerazione viene attuata con una
soluzione concentrata di cloruro di sodio.
2RNa + Ca 2+  R2Ca + 2Na+ R2Ca + 2Na+
Come tutte le reazioni reversibili si raggiungerà un
equilibrio che può essere rappresentato da:
K = [ R2Ca ][Na+]2/[RNa]2 [Ca 2+ ]
Dove con [R2Ca] e [RNa] si rappresentano
le concentrazioni superficiali degli ioni nella resina, cioè le concentrazioni
in fase solida degli ioni, dei quali è difficile conoscere esattamente
l’attività.
L’espressione non indica una vera costante di
equilibrio, ma un coefficiente di selettività, cioè la capacità della resina di
scambiare gli ioni Na+ con gli ioni Ca2+.
Per k > 1 la reazione procede verso destra.
-Le resine cationiche deboli sono costituite da
acido polimetacrilico nel quale il gruppo funzionale acido è un carbossile; non
sono in grado di scambiare cationi di acidi deboli, ma rispetto ai cationi di
acidi forti hanno maggiore capacità di scambio e vengono rigenerate da
soluzioni di acido cloridrico più diluite ( 5-6% ).
ResCOOH + Na+  ResCOONa + H+ ResCOONa + H+
- Le resine anioniche funzionano solo in ciclo
ossidrile; quelle forti operano attraverso ammoni quaternari supportati su
polistirene, che scambiano anioni di acidi forti( per esempio ioni cloruro) e
deboli (per esempio ioni cianuro) cedendo ioni ossidrili e vengono rigenerate
con soluzioni di soda caustica al 4-5% .
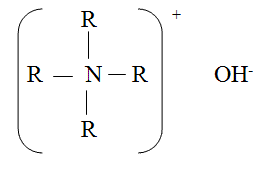
- Le resine anioniche deboli sono costituite da
polistirene che presenta gruppi amminici, scambiano solo anioni di acidi forti
e vengono rigenerate con soluzioni concentrate di carbonato sodico.
Le resine cationiche in forma acida e le resine
anioniche in forma basica si comportano
come acidi e basi; si hanno acidi e basi forti e deboli, analogamente si hanno
resine cationiche ed anioniche forti e deboli in funzione delle caratteristiche
dei gruppi attivi presenti.
|
Caratteristiche
|
Resine cationiche
Fortemente acide
|
Resine cationiche
Debolmente acide
|
Resine anioniche
Fortemente acide
|
Resine anioniche
Debolmente acide
|
|
Gruppi attivi
|
-SO3H
|
-COOH
|
Ammonici quaternari
|
amminici
|
|
Densità apparente g/l
|
800 - 900
|
700 - 800
|
570 - 700
|
600 - 680
|
|
Capacità di scambio meq/cm3
resina rigonfiata
|
2 – 2,5
|
3,5 – 3,8
|
1 – 1,5
|
1,5 -2
|
|
Max temperatura di
esercizio °C
|
120
|
100
|
40
|
100
|
|
Rigenerante
|
H2SO4;
HCl;NaCl
|
HCl
|
NaOH
|
NaOH;
Na2CO3
|
Processi di trattamento con resine (I)
Il trattamento con resine avviene facendo passare l’
acqua in una colonna contenente un letto di resina : il letto è generalmente
fisso , cioè le sferette sono tenute ferme e l’ acqua passa attraverso lo
strato di resina, talvolta si usa un letto fluttuante, cioè le sferette sono in
sospensione nella colonna, non escono per la presenza di appositi setti con
fori di dimensioni inferiori al diametro delle sferette stesse e l’ acqua
entrando in colonna fluidifica il letto della resina.
La resina dopo aver scambiato un dato quantitativo
di ioni viene rigenerata, le operazioni di rigenerazione avvengono con questa
sequenza:
 lavaggio in controcorrente con acqua, per allontanare le eventuali
sostanze estranee- detriti, pagliuzze, sabbia ecc,- che possono essere state
trattenute dal letto e per ridistribuire il letto, che con il passaggio dell’
acqua da trattare subisce delle stratificazioni;
lavaggio in controcorrente con acqua, per allontanare le eventuali
sostanze estranee- detriti, pagliuzze, sabbia ecc,- che possono essere state
trattenute dal letto e per ridistribuire il letto, che con il passaggio dell’
acqua da trattare subisce delle stratificazioni;
 immissione della soluzione rigenerante alla temperatura e con la
concentrazione e portata, prescritte per il tipo di resina;
immissione della soluzione rigenerante alla temperatura e con la
concentrazione e portata, prescritte per il tipo di resina;
 lavaggio in equicorrente con acqua deionizzata per eliminare il
rigenerante in eccesso; a volte si impiega acqua grezza ma si ha una perdita
della capacità di scambio.
lavaggio in equicorrente con acqua deionizzata per eliminare il
rigenerante in eccesso; a volte si impiega acqua grezza ma si ha una perdita
della capacità di scambio.
I principali campi di applicazione delle resine a
scambio ionico sono i successivi:
 addolcimento delle acque;
addolcimento delle acque;
 decationizzazione
decationizzazione
 demineralizzazione.
demineralizzazione.
Addolcimento delle acque.
Prima della
diffusione dei processi di scambio ionico la rimozione della durezza delle
acque veniva effettuata mediante reazioni chimiche, che comportavano la
precipitazione dei sali di calcio e di magnesio sotto forma di composti a basso
prodotto di solubilità e la separazione del precipitato in appositi
decantatori-sedimentatori.
Un tipico trattamento
chimico è il processo a calce-soda nel quale la calce elimina la durezza
temporanea e la soda elimina la durezza permanente:
Ca(HCO3)2
+ Ca(OH)2  2CaCO3 + 2 H2O 2CaCO3 + 2 H2O
CaSO4
+ Na2CO3  CaCO3 + Na2SO4 CaCO3 + Na2SO4
Ora la semplice eliminazione della durezza viene
effettuata con addolcitori costituiti da resine cationiche operanti in ciclo
sodico. Nella fase attiva di addolcimento viene eliminata sia la durezza da
carbonati ( durezza temporanea ) sia la durezza permanente dovuta agli altri
sali di calcio e magnesio presenti, principalmente cloruri e solfati. La resina
sostituisce agli ioni calcio e magnesio ioni sodio; nella fase di rigenerazione
con salamoia si ottiene un eluito contenente oltre al cloruro sodico in
eccesso, i cloruri di magnesio e di calcio in quantità equivalente a quella
sottratta all’ acqua dura, ma contenuti in volumi molto minori e
conseguentemente a concentrazione molto più elevata.
Le reazioni, riferendosi ai soli sali di calcio,
sono:
2RNa + Ca(HCO3)2  R2Ca
+ 2NaHCO3 R2Ca
+ 2NaHCO3
2RNa + CaSO4  R2Ca
+ Na2SO4 R2Ca
+ Na2SO4
2RNa + CaCl2  R2Ca + 2NaCl R2Ca + 2NaCl
Si ha l’ allontanamento
degli ioni Ca2+ e Mg2+ ed in soluzione si hanno ioni Na+.
Si ottengono durezze molto
basse, ma si ha lo svantaggio, specie dovendo abbattere durezze molto alte, di
un’ elevata quantità di NaHCO3 , che a caldo si decompone e
conferisce all’ acqua una elevata alcalinità secondo la reazione:
NaHCO3  NaOH
+ CO2 NaOH
+ CO2
Nell’impiego industriale sovente si fa uso di
apparecchiature con due colonne in parallelo, una delle quali è in fase di
lavoro mentre l’altra è in fase di rigenerazione.
L’acqua addolcita in ciclo sodico ha la stessa
salinità di quella originale, avendo soltanto scambiato con ioni sodio gli ioni
calcio e magnesio. La sua alcalinità titolabile (cioè la sua concentrazione in
idrogenocarbonati) non è cambiata. Per rimuovere, oltre alla durezza, anche l’
alcalinità, si può far uso di due colonne, che operano in parallelo e tra le
quali l’ acqua da trattare viene ripartita in opportuno rapporto. Una colonna
opera a ciclo sodico; l’ altra opera a ciclo idrogeno secondo uno schema di
reazione che viene così rappresentato:
2RH + Ca(HCO3)2  R2Ca + 2 CO2+ 2H2O R2Ca + 2 CO2+ 2H2O
2RH + CaSO4  R2Ca
+ H2SO4 R2Ca
+ H2SO4
2RH + CaCl2  R2Ca
+ 2HCl R2Ca
+ 2HCl
Mescolando nella giusta proporzione gli effluenti in
uscita dalle due colonne, l’acidità libera proveniente dalla colonna a ciclo
idrogeno neutralizza gli idrogenocarbonati in uscita dalla colonna a ciclo
sodico:
HCO3- + H+  H2O
+ CO2 H2O
+ CO2
L’anidride carbonica potrà essere eliminata,
mediante un degasatore, cioè facendola passare attraverso una colonna riempita
con anelli Rasching, dove viene insufflata aria in controcorrente; la corrente
d’ aria trascina con sé l’anidride carbonica.
Poiché il ciclo con la resina cationica nelle due
forme presenta alcuni inconvenienti, principalmente legati alla corrosività che
si ha nella parte dell’ impianto del ciclo acido, si ricorre al trattamento con
due resine cationiche in forma acida, di cui una debole, che scambierà solo il
calcio ed il magnesio dei bicarbonato, l’ altra forte in una colonna successiva
in materiale resistente alla corrosione, che scambierà il Ca ed il Mg dei
solfati e dei cloruri. La CO2 viene allontanata per degasaggio e l’ acidità
viene neutralizzata da uno scambiatore finale a resina anionica.
In questo caso si ha il vantaggio di avere un’ acqua
a bassissima durezza ed alcalinità quasi assente.
Decationizzazione
A volte è necessario l’allontanamento di tutti i
cationi: si usano resine cationiche in forma idrogeno. Tale tecnica può essere
il primo stadio della demineralizzazione totale di un’acqua, o uno specifico
trattamento per rimuovere Cd2+, Zn2+, Cu2+ Ni2+
da acque reflue industriali.
La rigenerazione avviene con acidi HCl, HNO3,
H2SO4 e si possono ottenere soluzioni concentrate dove è
possibile ricuperare metalli precipitandoli come idrossidi; si opera con una o
più colonne in serie.
La demineralizzazione.
Viene definito il trattamento di completa
eliminazione dei sali in soluzione, un tempo possibile solo mediante la distillazione.
Si usano in serie due tipi di resine, una cationica
in ciclo idrogeno e una anionica in
ciclo ossidrile, eventualmente seguite da un degasatore.
Per esempio:
2RH + 2 NaCl  2RNa + 2 HCl 2RNa + 2 HCl
2ROH + 2HCl  2RCl + 2 H2O 2RCl + 2 H2O
In questo modo gli ioni sodio sono stati
completamente sostituiti da idrogenioni e gli ioni cloruro da ossidrilioni, con
formazione di acqua.
La resina cationica si rigenera con un acido forte e
quella anionica con una base forte NaOH, NH3 e Na2CO3.
La rimozione di inquinanti.
Resine scambiatrici opportunamente “costruite” sono
in grado di trattenere inquinanti molto pericolosi, quali cianuri e gli ioni
dei metalli pesanti; trovano impiego nel trattamento delle acque provenienti
dalle industrie che ne fanno uso, come quelle galvaniche.
Il trattamento delle acque di rigenerazione, vengono
affrontate con metodi tradizionali, ossidazione dei cianuri, precipitazione
degli idrossidi metallici, rimozione di alcuni contaminanti dalle acque
potabili, come i nitrati.
Complessazione
In certi casi non è necessario rimuovere i
contaminanti: è sufficiente modificare la forma nella quale sono presenti. Per
certe operazioni tecnologiche sono dannosi gli ioni calcio o gli ioni ferro
liberi, ma non quelli complessati: si fa uso dei cosiddetti sequestranti.
Per esempio i polifosfati, sottraggono ioni calcio
dalla soluzione:
(P3O10)5- + Ca2+  (CaP3O10)3- (CaP3O10)3-
I polifosfati trovano impiego nell’industria della
detergenza ed in quella tintoria, anche se per molti usi la legge italiana ne
limita fortemente l’ impiego. Altri complessati utilizzati industrialmente sono
i citrati, i derivati dell’ acido nitrilotriacetico e quelli dell’ acido
etilendiamminotetraacetico.
Depurazione per adsorbimento.
Per l’ allontanamento di alcune sostanze contenute
nelle acque si ricorre all’ adsorbimento: l’ acqua da trattare viene messa in
contatto con sostanze granulari fortemente porose, talvolta contenenti anche
gruppi attivi ad azione selettiva, che adsorbono le sostanze contenute nell’
acqua stessa.
Come materiali adsorbenti si usano: carboni,
silicoalluminati, silice, polimeri ed altri prodotti che abbiano una grande
superficie specifica.
L’ acqua da trattare viene passata su letti di
materiale adsorbente oppure mescolata con questo e poi filtrata; si usano
colonne riempite con materiale granulare, si fa passare l’ acqua su filtri
contenenti uno strato di sabbia o altri materiali per esempio antracite,
pomice, materie plastiche ed altri.
I carboni adsorbenti sono prodotti che derivano
dalla carbonizzazione di materiali vegetali, sono caratterizzati da una grande
superficie specifica che dà luogo a fenomeni di adsorbimento. Il loro potere
adsorbente viene aumentato con il processo di attivazione, che consiste in un
trattamento termico ad alta temperatura in atmosfera inerte, o sottovuoto, o in
presenza di particolari sostanze come il vapor d’ acqua o l’ acido cloridrico.
Nel contatto tra materiale adsorbente e sostanze
presenti nell’ acqua spesso si verifica oltre al semplice adsorbimento fisico
un chemiadsorbimento.
Nel primo si instaura un legame tra adsorbente ed
adsorbato, sono in gioco le forze di Van der Waals ; nel secondo intervengono
forze con energie dello stesso ordine di quelle di legame e l’ adsorbimento può
anche risultare irreversibile.
Nel trattamento delle acque si cerca di avere un
adsorbimento fisico, sia perché il materiale adsorbente viene utilizzato più
volte, sia perché interessa il recupero delle sostanze adsorbite.
Le variabili che influenzano l’ adsorbimento sono
numerose:
 natura dell’ adsorbato;
natura dell’ adsorbato;
 dimensioni delle particelle;
dimensioni delle particelle;
 porosità e forma dei canalicoli dell’ adsorbente;
porosità e forma dei canalicoli dell’ adsorbente;
 temperatura;
temperatura;
Un adsorbente richiede lunghi tempi per raggiungere
l’ equilibrio tra quantità adsorbita e concentrazione dell’ adsorbato nel
liquido; per questo motivo in pratica si lavora molto lontani dall’ equilibrio
e si sfrutta solo una parte della capacità adsorbente.
Per desorbire i composti
trattenuti e rigenerare l’ adsorbente, si usano tecniche diverse: nella
rigenerazione si ha generalmente un decadimento della capacità di adsorbimento,
sia perché non tutte le sostanze adsorbite vengono restituite, sia perché vi
sono reazioni di ossidazione, clorurazione ecc, e perché si altera la porosità
e la struttura dei granuli, anche per rottura degli stessi; i carboni
adsorbenti vengono di solito rigenerati prima mediante un lavaggio e poi per
trattamento termico , si usano forni tipo Herreshoff e si opera a 800-900°C; i
trattamenti di rigenerazione comportano perdite di circa il 10% di carbone ed
una caduta nella capacità di adsorbimento.
Le colonne di carbone attivo
diventano spesso sede di attività batterica e richiedono processi di
disinfezione periodica che ne riducono l’ attività; la normativa italiana
vieta, in linea di massima, l’ impiego domestico di filtri a carbone attivo,
per ragioni igienico - sanitarie, a meno che non siano corredati di dispositivo
atto ad eliminare gli inconvenienti elencati.
Il trattamento con carbone
attivo non è ammesso per le acque minerali .
Oltre ai carboni si usano
come adsorbenti i polimeri macroporosi, che hanno una certa attività di scambio
quando si deve allontanare anche gli ioni in soluzione; sono ottenuti mediante
la copolimerizzazione di particolari monomeri: stirene, divinilbenzene, esteri
ed acidi acrilici che, allontanati dopo polimerizzazione, creano nel polimero
una struttura fortemente porosa.
Essendo ionicamente
inattivi, la capacità adsorbente non viene influenzata dalla salinità delle
soluzioni, non vengono attaccati dai composti presenti in soluzione: acidi,basi,
sostanze ossidanti, ecc. ad eccezione che non siano ad elevata concentrazione.
A seconda della struttura
polimerica adsorbono selettivamente alcuni composti; per l’ adsorbimento di
composti apolari si usano i copolimeri a matrice stirenica, quelli a matrice
acrilica si usano per composti a polarità intermedia.
Caratteristiche:
 alta selettività;
alta selettività;
 buona capacità di scambio;
buona capacità di scambio;
 facile rigenerabilità per stripping con vapore o per eluizione con
solventi ;
facile rigenerabilità per stripping con vapore o per eluizione con
solventi ;
 possibilità di recupero delle sostanze adsorbite.
possibilità di recupero delle sostanze adsorbite.
Campi di applicazione:
 allontanamento di solventi clorurati;
allontanamento di solventi clorurati;
 allontanamento di solventi aromatici;
allontanamento di solventi aromatici;
 depurazione di acque, già trattate con altri processi, da residui di
fenoli;
depurazione di acque, già trattate con altri processi, da residui di
fenoli;
 depurazione di acque di scarico di industrie che producono composti
organici.
depurazione di acque di scarico di industrie che producono composti
organici.
 4/5
4/5

|